
 |
|
|
Литература --> Изомерия в производственном цикле грузка активирует прогрессивные расходы . Задача конкретного анализа на данном предприятии - путем изучения структуры издержек определить эти критические точки эк;ономичности работы предприятия. Аналогичный метод исследования применяется нри определении низшей границы цепы при политике форсирования сбыта продукции за границей (политика dumping ), при чем рентабельной ценой является не цена, покрывающая полную себестоимость, а обеспечивающая лишь покрытие пропорциональных издержек. При оценке работы предприятия, при проектировании мероприятий рационализаторского характера, при организации нового производства или нового предприятия исследование калькуляции, помимо анализа отдельных частей, доллсно вестись и в плоскости вскрытия взаимозависимости отдельных элементов. Технич. организация предприятия представляет собою сложный комплекс материально-технич. и экономич. факторов, оптимальное сочетание к-рых постоянно меняется. Соотношение в цене сырья, топлива, рабочей силы, % на капитал, стоимости тарифов и пр. предопределяет и определенную техническую физиономию предприятия, степень его механизации и т. д. Все это ставит науку о К. не столько в разряд бухгалтерских, сколько техно-экономических дисциплин. Задачи К. определяют ее место в системе организации предприятия. Калькуляцион. отдел является связующим звеном между технич. и бухгалтерской частями предприятия. На практике структура калькуляцион. отделов и взаимоотношение их с др. частями предприятия чрезвычайно пестры. В одних предприятиях они целиком подчинены технич. части, в других входят в состав бухгалтерии, в третьих поделены между ними так, что технической К. (изучением норм расхода сырья, материалов, энергии, рабоч. времени и пр.) занимается технич. часть предприятия, ценностной-бухгалтерия. За границей отмечается определенная тенденция передачи К. из бухгалтерских ячеек в ведение технич. и производственных бюро (особенно в С.Ш.А). Кроме анализа издерлек производства по К. внутри предприятия, огромное значение приобретает анализ их путем сравнения К. между аналогичными предприятиями. Иностранная литература по вопросам организации и экономики предприятий уделяет очень бо.льшое внимание методике таких сравнений (работы Шмаленбаха, Шульце-Мерина и др.). С этой целью ведется большая работа по унификации методов калькулирования в различных отраслях промышленности. Характерно, что несмотря на коммерч. тайну, оберегающую данные о себестоимости, за границей создается ряд объединений по обмену между собою К. В Германии унифи-кационная работа в области методики калькулирования ведется Комитетом хозяйственности (Ausschuss fur wirtschaftliclie Fer-tigung), издавшим Grundplan der Selbstkos-tenrechnung>, a также и другими организациями (в частности VDMA-Verein deutscher Maschinenbau-Anstalten). В Соед. Штатах Америки в 1919 г. была основана National Association of Cost Accountant (N.A.C.A.), созывающая по вопросам методики калькулирования международные съезды и издающая специальный журнал и труды. У нас этой работой занято Бюро цен при президиуме ВСНХ СССР , периодически созывающее конференции по отраслям промышленности и выпустившее целую библиотечку (ок. 30 выпусков) Методов калькулирования по отдельным отраслям. . Лит.: Смит М. Н., Экономич. основы калькуляции, М., 1926; Никольсон Дж. и Горбах Дж., Основы калькуляции, Москва, 1926; Т е р-Акопьянц С. Г., Основы правильной калькуляции, Москва, 1925; Ш п е р л и х А., Накладные расходы в себестоимости производства, М.-Д., 1927; Фишер Р., Калькуляция и организация предприятия, Л., 1926; Методы калькулирования в промышленности, 30 вып. по отдельным отраслям, М., 1927-29; Молчанов С. А., Издержки производства промышленности СССР, М., 1926; L е 11-п е г F., Selbstkostenberechnung industrieller Ве-triebe, Frankfurt а/М., 1923; Schmalenbach Е., Grundlagen der Selbstkostenreclinung u. Preispolitik, Leipzia;, 1927; Lehman M. R., Die industrielle Kalkulation, Berlin, 1925; R a h m W., Die Unkosten im Fabrikbetrieb, Stg., 1927; ряд статей в Hand-worterbuch der Betriebswirtschaft, Stuttgart. 1926-28; Atkins P., Industrial Cost Accounting for Executives, New York, 1924; Castenholz W., Cost Accounting Procedure, Chicago, 1925. C. Молчанов. КАЛЬЦИЙ, Ca, химич. элемент II группы периодической системы, аналог Sr, Ba и Ra, составляющий вместе с ними подгруппу т. н. щелочноземельных металлов; ат. вес 40,07, ат. номер 20,. В свободном состоянии К.-серебристо-бельй! металл, на воздухе быстро желтеющий (вследствие образования пленки азотистого соединения), довольно вязкий, способный коваться и вытягиваться; твердость его несколько выше, чем свинца. Кристаллизуется в ромбоэдрах или гексагональных табличках. Уд. вес 1,52- 1,55 (различные образцы металла дают от 1,413 до 1,85); t%,, 800-810°; около 1 170°. Спектр К. характеризуется рядом ярких линий в оранжевой части спектра, несколькими линиями в фиолетовой и полосой в зеленой. В продажу К. выпускается в виде зерен или палочек; сохраняется лучше всего в легких минеральных маслах. К. обладает ярко выраженными металлич. свойствами и высокой реакционной способностью. В совершенно сухом воздухе он устойчив, во влажном-быстро окисляется на поверхности. При нагревании до 300° загорается и горит ярким пламенем, соединяясь не только с кислородом, но и с азотом атмосферы, при чем образуется смесь окиси-СаО и нитрида-CagNg. При нагревании в струе азота или водорода до f красного каления К. соединяется с ними, образуя азотистый К. (CagNg) или водородистый К. (СаНз). В аналогичных условиях К. легко соединяется с галоидами, серой, фосфором, мышьяком, висмутом, углеродом (образуя карбид, СаСа) и кремнием; дает ряд сп.лавов с магнием, цинком, алюминием, оловом и никелем. При высоких t° К. восстанавливает окислы многих металлов, а также и металлоидов, напр.:. BgOg, SiOj, СО2 (образуя СаСз и СаО), СО (.ташь частично), N0, Р2О5 (со взрывом), SO2 и SO3. При i° 5=800° К. реагирует с фтористыми и хлористыми солями Na и К, восстанавливая свободный щелочной металл. Сероводород, аммиак и углеводороды при нагревании с К. разлагаются, при чем последний дает соединения с элементами этих веществ. С аммиаком, при темп-ре не выше 15°, К. дает неустойчивое твердое соединение Са(МНз)4 <кальцийаммоний), легко распадающееся с образованием кристаллического кальций-амида, Ca(NH2)2- К. энергично разлагает при обыкновенной t° воду (но медленнее, чем калий или натрий), выделяя водород; бурно реагирует с разбавленными к-тами, с ангидридами и хлорангидридами кислот; конц. соляная к-та на него почти не действует; дымящая серная кислота разлагается с выделением SO2 и S; обычная конц. H2SO4 выделяет также и HgS. Валентность К, во всех устойчивых его соединениях равна 2. По распространенности в природе К. занимает среди элементов пятое место; среднее содержание его в доступных исследованию слоях земного шара равно 3,25% по весу; в твердых частях земной коры К. составляет по весу ок. 3,5% (шестое место), в воде океанов-0,05%. Многие горные породы, образующие мощные залегания, состоят целиком или в значительной части из кальциевых солей: углекислого кальция (известняки, мел, мрамор, доломиты), сернокислого (гипс), фосфорнокислого (фосфориты, апатиты) и фтористого К. (плавиковый шпат). Кремнекислый К. является составной частью огромного большинства природных силикатов. Нерастворимые соли К. образуют основу костей животных и раковин моллюсков, а растворимые содеряштся в воде природных бассейнов и в соках растений. Получение металлич. К. в чистом виде представляет большие трудности. Впервые К. был выделен Деви в 1808 году, но добывание его в технич. размерах началось лишь с 1904-05 гг. Металлич.* К. может быть получен двумя путями: чисто химическим и электрохимическим. Первый метод (восстановление солей К., напр. CaJ2 или смеси CaClg и КС1, металлич. натрием или магнием при высокой t°) не нашел применения в технике вследствие его дороговизны, плохих выходов (обратимость реакции) и нечистоты получающегося продукта. Электрохимические методы основаны на электролизе расплавленной соли; электролитом служит CaClg (t°.m 780°), или смесь из 100 в. ч. CaClg и 16,5 в.ч. CaF2( ° , 660°), или же смесь 85% CaCla и 15% КС1. Конструкция печи (ванны), предложенная в 1902 г. Бор-херсом для промышленных целей, представляла собсю цилиндрический сосуд, сложенный из угольных брусков или плиток и служивший анодом; дно его покрывалось набойкой из СаР2, а остальное пространство заполнялось электролизируемой солью. Соль расплавлялась током при помощи тонкого угольного стержня-сопротивления, зажатого предварительно между анодом и катодом; в качестве последнего брали железный прут, расположенный вертикально по оси печи и своей нижней частью погру-экенный в электролит. К., отлагающийся на катоде в виде губчатой массы, вычерпы- вался ложкой и погружался в керосин. Горячим прессованием сырого продукта отжимали большую часть шлаков и получали металл примерно 90%-ной чистоты. Дальнейшая очистка (переплавление в закрытых железных или никелевых тиглях) давала 99- 99,3%-ный К. Другой способ электролиза, принадлежащий Ратенау (1904 г.) и технически наиболее совершенный, характеризуется применением т. н. прикасающегося электрода: катод (железный или медный) поддерживается при возможно низкой t° и не погружается в э.т1ектролит, но лишь соприкасается с его поверхностью. Выделяющийся металл застывает на нижнем конце катода; последний в процессе электролиза постепенно приподнимают так, что К. нарастает на нем в виде столбика неправильной формы, поверхность которого защищается от окисления коркой шлака; этот столбик в дальнейшем сам служит электродом. Современный тип заводской ванны (см. фиг.): Разрез по А-В 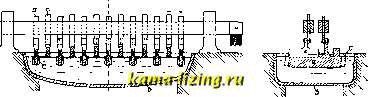 железный резервуар Ь в форме корыта, вдоль к-рого, на подобие зубьев гребенки, расположены электроды - непогруженные железные катоды к чередуются с погруженными анодами а, угольными или графитовыми, обернутыми металлической сеткой с. Процесс ведется при температуре 660-800°, напряжении ванны 18 - 42 V и плотности тока 50 - 250 A/cjn; продукт содержит до 98% чистого К. Примерный состав продажного электролитическ. кальция (в % по весу): 98,01 Са, 0,94 С1, 0,837 О, 0,14 Mg, 0,032 Si, 0,028 AI, 0,013 Fe. Выходы по току меняются в пре-де.тах 30-82%; соответственно этому для получения 1 кг К. требуется 42-i-llO kWh. Весьма значительная часть энергии тока расходуется на нагревание электролита. По мет )ду Ратенау до настоящего времени ведется техническое получение К. на электро-химич. заводе в Биттерфельде (Германия); продукция его, однако, незначит льна. Применение К. в промышленности пока еще очень ограничено. Он употребляется вместо щелочных металлов для обезвоживания некоторых органических соединений; по сравнению с калием и натрием, для него является большим преимуществом менее бурное реагирование с водой и меньшая щелочность его гидроокиси. Большие надежды возлагались на К. удобный аккумулятор водорода: водородистый К., СаНз (см. Кальция соединения), одно время готовился в Германии в техническ. масштабе для нужд воздухоплавания; производство это, однако, не развилось вследствие дороговизны К. Де.тались также попытки использовать К. в металлургии как восстановитель и как Средство для удаления (связывания) серы и фосфора. Иногда К. при- бавляют в небольших количествах (1-3%) к свинцу для придания последнему большей твердости. Наконец, в самое последнее время К. (в сплавах с другими легкими металлами) нашел применение в качестве газообразователя при изготовлении газобетона (см.). Специфич. областей применения для к. не найдено. Лит.: Общая- стл.Нальци.ч соединения. М е та л-.лургия кальция - Изгарышев. Н А., Электрохимия и ее технические применения, Ленинград, 1929; Rathenau, <(Zeitschrift f. Elektro-chemie , Halle a/S., 1904, B. 10, p. 502; B i 1 li t e r. Die elektrochemisclien Verfaliren d. chemischen Gross-industrie, B. 3, Leipzig, 1918: R e g e I s b e r g e r, Chemische Technologie d. Leichiraetallo u. ihrer Legie-rungen, Leipzig, 1926; Г. П. 9667as 144777, 153731, 155433. B. Янковсиий. КАЛЬЦИТ, и 3в e ст ко в ый ш п ат, минерал, одна из полиморфных разностей углекислого кальция; принадлежит к ромбоэд-рич. классу гексагональной системы; кристаллы имеют форму столбчато-призматическ. и вытянутых ромбоэдров; спайность по плоскостям ромбоэдра в высшей степени совершенная; прозрачен, или только просвечивает, или непрозрачен; бесцветен или окрашен примесями в зеленый, голубой, красный, желтый, бурый и черный цвета; блеск стеклянный, а на спайных плоскостях иногда перламутровый; хрупок; тв. 3; уд. в. 2,72; хим. состав-СаСОз (56% СаО и 44% СО а). Перед паяльной трубкой не плавится, плавится только при высоких давлении (110 atm) и Г (1 289°); при 825° начинает разлагаться на СаО и СО а; растворяется в НС1 даже на холоду. К.молет находиться в двух формах-а и /3; переход из одной формы в другую совершается при 970° ± 5° (форма а выше, )5ниже этой t°); различаются эти формы термически; оптических и кристаллографич. различий в формах пока не установлено. К. после кварца самый распространенный минерал, важная составная (иногда связующая) часть осадочных пород водного происхождения; в изверженных породах считают его продуктом вторичным, хотя в последнее время допускают магматическое его образование. Сложение К. различно: в известняках-плотное, в мраморах-кристаллическое, в мелу, натечных туфах, пещерных сталактитах-рыхлое, землистое. К.-важнейший петрофицирующий (вызывающий окаменение)минерал. Применение слагаемых им горных пород разнообразно: изготовление портланд-цемента, строительных и декоративных камней, флюсов в металлургии, искусственных удобрений. Совершенно прозрачная и бесцветн. разность К.-и слайд-с к и й, или удвояющий, шпат-обладающая сильным двойным лучепреломлением, применяется при изготовлении оптической системы многих приборов применяемых для поляризации света (призмы Н и к о л я). Главное месторождение этого шпата - о-в Исландия (близ Гельгустадира). Значительно уступающий по качеству материал добывается из америк. месторождений (Калифорния, Warner Range близ Cedarville, Modoc County). Данные поисковых работ 1926/27 г. подтверлдают возмон-сность нахождения и в СССР технически пригодного исландского шпата в промышленных количествах. В Сибири месторождение исландского шпата на- ходится у с. Тамбар, Ачинского окр., на С.Алтае в горе Чебаниха, в Якутской автономной республике в Аламдлсахском месторождении. См. Спр. ТЭ,г. I. Лит.: Годовой обзор минер, ресурсов СССР за 1926/27 г.. Л., 1928; НИ , т. 1, Л., 1926; Лебедев г.. Учебник минералогии, СНБ, 1907; Ш т и н и И., Iv[ у ш к е т о в Д., Технич. геология, М.-Л., 1925; Fay А., А Glossary of the Mining a. Mineral Industry, Waschington, 1920; L a d о о R., Non-metallic Minerals, N. Y., 1925. КАЛЬЦИЯ СОЕДИНЕНИЯВ своих соединениях Ca фигурирует как двувалентный элемент и образует только один вид ионов, а именно бесцветный катион Са . Окись, СаО,-чрезвычайно прочное соединение, непосредственно дающее с водой гидрат окиси, Са(0Н)2. Последний представляет собою вещество со свойствами основания, сильно ионизированное, но отличающееся от едких щелочей малой растворимостью в воде. Хлористая и азотнокислая соли легко растворимы в воде; фтористая, углекислая и сернокислая-мало или вовсе нерастворимы. Ион Са не осаждается сероводородом. От своих аналогов, Sr и Ва, кальций отличается меньшей растворимостью гидрата окиси, большей растворимостью сульфата и хромата, растворимостью хлорида и нитрата в спирте и оранжевым окрашиванием пламени солями Са. Способность к образованию комплексных ионов у Са слабо выраж;ена, но все же заметна: на это указывает, напр., значительное содержание кристаллизационной воды в его солях, образование двойных солей, гидратов и аммиакатов, а также часто наблюдаемое повышение растворимости солей Са в присутствии других веществ. Аналитич. определение Са в солях производят чаще всего весовым путем, осаждая Са-ион в виде углекислой или щавелевокислой соли; осадок после прокаливания дает СаО, которую и взвешивают. Иногда применяется осаждение Са в виде сульфата (в водно-спиртовой среде). В промытых осад- ках углекислой или щавелевокислой соли можно определять Са и объемным путем, растворяя их в соляной кислоте, после чего в первом случае избыток НС1 оттитровывает-ся щелочью, а во втором-свободная щавелевая к-та титруется при помощи КМПО4 (в присутствии солей Мп). Предложенное Рйглером газоаналитич. определение Са состоит в том, что анализируемую соль переводят в мало растворимый иодат, Ca(J03)2, который обрабатывают сернокисльш гидразином и, исходя из ур-ия реакции Ca(J0s)2 + 3 NjHi + HjSO. = CaSOi+2 НJ + 6HjO + 3 N., вычисляют содержание Ca no объему выделившегося азота. Азотнокислый кальций, Ca(N03)., кристаллизуется с четырьмя, тремя и одной молекулами HgO; хорошо растворим в воде и спирте. Безводный Са(МОз)2 имеет уд. в. 2,36 и около 560°; трехводная соль плавится при 51,1°; четырехводная соль плавится при 42,3° и имеет уд. вес 1,82. Растворимость в 100 г воды (для безводной соли) при 0°-93 г, при 18°-121,2 г. Насыщенный при 18° (54,8%-ный) раствор имеет уд. вес 1,548; раствор, Насыщенный при кипении, со-дерлсит 351,2 г соли на 100 г воды и имеет t°n. 152° (шах); 30%-ный раствор име-
|