
 |
|
|
Литература --> Производство газовых тканей жня в стояка. При вращении стержня винт Z, вращающийся на резьбе в неподвижной гайке у, будет опускаться, головка к отодвинется от шара, и вода пройдет внутрь через щели кольца т в стояк и в колонку. 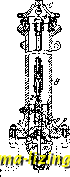 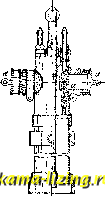 Фиг. 3. Фиг. 4. При дальнейшем опускании винта выступ и упрется в шар и повлечет его за собой вниз, при чем опускание шара значительно облегчается давлением на него сверху воды, проходящей через m в стояк. Для выпуска воды из стояка при закрьшании Г. в стояке имеется отверстие е, которое при опускании винта Z закрывается связанною с ним за-двилшою р, а при поднимании винта (при закрывании Г.) задвижка также поднимается, и вода из стояка уходит через отверстие е. Два патрубка d, к которым привинчиваются пожарные рукава, закрываются каждый особой задвижкой а. См. Пожарное дело. Лит.: Гениев Н. Н., Городские водопроводы, 2 изд., М.-Л., 1928; БринкгаузП., Городская водопроводная сеть труб, пер. с нем., Москва, 1928. См. такн;е лит. Водоснабжение. Д. Цейтлин. ГИДРАТАЦИЯ, химич. реакция присоединения воды, при чем, в отличие от гидролиза (см.), присоединяющая воду молекула не претерпевает разложения. Относительно образования гидратов минеральных соединений см. Гидраты. В молекулах органич. соединений элементы воды присоединяются по месту кратных связей; реакция Г. требует здесь содействия катализаторов. Г. этиленовых углеводородов дает спирты (в присутствии разбавленной серной к-ты) и альдоли. Напр., Г. изобути-лена дает триметилкарбинол: (СНа)гС:СНг + НО = (СЫ,)2-С(0Н)-СНа; реакции этого рода находят технич. применение-получение спиртов из нефтяных газов. Г. кретонового альдегида под влиянием разбавленной соляной к-ты дает альдоль- /?-оксимасляный альдегид: СНз-СН:СН-С0П + НО = СН,-СН(0Н)-СН,-С0Н. Все эти реакции протекают на холоду. В результате Г. ацетиленовых углеводородов под действием разбавленной серной кислоты получаются альдегиды и кетоны: RC : сн + НгО = R-CHa-COH RC : CR + IUO = R-CHj-CO-R. Особенно ваясна Г. этих соединений под влиянием солей ртути как катализаторов (Кучеров). Ацетилен дает уксусный альдегид: сн : сн + НзО = СНа . сон. Г. ацетилена идет при 300° в присутствии твердых катализаторов: ZnO, NiO, FeO. При действии разбав.тенной азотной кислоты на пинен получается тернии (1,8-мен-тандиол): CioHie -Ь 2 НаО = C,oHj Oj. Гидратация нитрилов ведет к образованию амидов. Реакции Г. распространены в природе и применяются в технике. Помимо приготовления различных химических продуктов, ими пользуются при сушении (так, фосфорный ангидрид и хлористый кальций, жадио соединяясь с водой, могут отнимать воду у других веществ, менее прочно ее удерживающих); в строительном деле реакции Г. обусловливают схватывание цемента, применение гипса и пр. А. Баландин. ГИДРАТЫ, соединения с водой. Этот термин применялся раньше только для обозначения таких соединений, в которых присоединяющаяся вода коренным образом изменяет характер вещества. Так, напр., присоединяя воду к окислам металлов натрия или кальция (NajO и СаО), получаем Г. окисей, NaOH и Са(0Н)2, обладающие сильными основными, или щелочными свойствами. При соединении воды с окислами неметаллических элементов, напр., с фосфорным ангидридом Р2О5 или трехокисью серы SO3, получаются кислые гидраты-кислоты фосфорная Н3РО4И серная H2SO4. Эти реакции идут быстро и сопровождаются выделением значительного количества тепла (так, при образовании H2SO4 из SO3 и HjO выделяется 21 Cal, при гидратации СаО-18 Cal). В настоящее время название Г. применяется преимущественно для обозначения таких соединений воды с другими веществами, в которых связь воды с остальными частями слабее, чем это имеет место в обычных химич. соединениях, и из которых вследствие этого вода м. б. удалена сравнительно легко: повышением i°, изменением давления, концентрации и т. д. К таким соединениям относятся прежде всего кристаллич. Г., и,лн кристаллогидраты, где одна или несколько молекул вещества соединяются с одной, двумя или ббльшим числом молекул воды. Вода в таких Г. называется к р и-сталлизационной, так как ее наличие в известном стехиометрич. отношении определяет геометрич. форму и связанные с ней свойства кристалла. Так, безводный сульфат меди CUSO4 - бесцветное соединение, кристаллизующееся в призматическ. иголочках ромбич. системы, а пятиводн. Г. CuSO.5 Н2О образует крупные синие кристаллы трикли-нич. системы; при нагревании до 100°- он теряет 4 молекулы воды, а при 240°-последнюю, переходя в безводный сульфат, при чем кристаллы его распадаются. Кристаллогидраты обладают определенной упругостью пара. Если упругость пара кристаллогидратов больше, чем упругость пара воды в воздухе при данной темп-ре, то они при хранении на воздухе теряют свою кристаллизацион. воду-выветривают-с я- К таким кристаллогидратам принадле-ишт, напр., глауберова соль NagS0.10 HgO, теряющая при долгом хранении всю свою воду. Если же ее хранить в закрытом сосуде, выветривание продолжается лишь до тех пор, пока упругость паров воды в замкнутом пространстве над солью не станет равной упругости пара глауберовой соли. Хлорное железо FeClg, или FegClg, образует с водой ряд твердых Г., содержащих 12, 7, 5 и 4 молекулы воды на 1 молекулу FeaClg. Их 1°пл. лежат соответственно при 37°, 32,5°, 56° и 73,5°. Состав получающегося Г. зависит от 1° н от количественного соотношения FcsCle и воды. Рузбум (Roozeboom) исследовал равновесие между этими веществами; его работы явились первым приложением правила фаз в химии. Если, с одной стороны, изменять темп-ру, а с другой- содержашге FeaClg в воде, то, при известных условиях, х.чорное железо начнет выпадать из раствора в виде Г. того и.ли иного состава. Эти соотношения прекрасно выраукаются кривой (см.фиг.), где на абсщюсах отложены ГегС1в4НгО , Н ГегС1в7НгО Температура i°, а на ординатах-концентрации, выраженные в виде числа молекул ¥о.\ на 100 молекул воды. Точка А выражает равновесие между водой и .яьдом (при 0°). При прибавлении безводи. FegCle точка замерзания начнет опускаться, и выкристаллизовывается только лед. Повышая содержание соли, можно понизить Г замерзания до -55° (точка В). В этом состоянии раствор является насыщенным по отношению к двенадцативодному гидрату, и при дальнейшем прибавлении соли начнет выпадать Г. состава FegCle. 12 НоО, а 1° замерзания повышается. В точке С насыщенный раствор имеет такой же состав, как и выпадающее тело, или, иначе говоря, при соответств. температуре (37°) из раствора выпадает вещество, одинаковое с ним по составу. Это и есть t°3acm. или *°ггл, двснад-цативодного Г. При дальнейшем повышении содержания соли t°n.ii. снова падает до точки перехода .D, при к-рой начинается образование нового, семиводного Г. Отрезок DN пзобраншет область т.н. м е т а с т а б и л ь-ного равновесия. Начиная с точки перехода F, выпадает пятиводпый Г., с точки Н-четырехводпый, с точки К-безводный хлорид железа. Нужно сказать, что самое существование четырех- и семиводного Г. было открыто после того как Рузбум заметил появление соответствующих перегибов на своей кривой. Выяснению химршеской природы Г. содействовала к о о р д и и а ц и о и н а я теория Вернера, согласно которой Г. являются частным случаем молекулярных 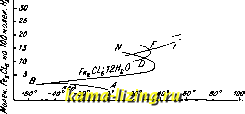 соединений, т. е. веществ, состоящих из связаьгаых меноду собою молекул более простых химич. соединений. Кроме молекул воды, также и молекулы аммиака, соляно11 к-ты, пиридина и других веществ могут входить в состав более сложных, к о м п л е к с-н ы X соединений, в которых они связаны химич. силами иного порядка, чем в обычных соединениях-так наз. побочными пли дополнительными валентностями (си. Валентность), или единицами сродства. В последнее время вопрос о природе Г. был рассмотрен Косселем с точки зрения электростатической теории строения химич. соединений. Эта теория не только объясняет притяжение молеку.ч воды к обладающим большим зарядом и малым объемом атомам (точнее-к ионам) преимуществегшо тя:к(:-лых элементов, но в некоторых случаях позволяет вычислить количество молекул Н2О, входящих в состав 1\ Рентгенографическое изучение кристаллических гидратов показа-.то , что молекулы Н2О входят как целое в структуру кристаллов и занимают онре-делешп>ге места в кристаллической репютке (см. Кристаллы). Многие химич. соединения, дающие с водой б. или м. прочные кристаллич. Г., находятся в гидратированпом состоянии и в водных растворах. Существование таких Г. в водном растворе впервые предполо-лшл и обосновал Д. И. Менделеев. Изучая зависимость физич. свойств (гл. обр. илот-ности) растворов серной к-ты от концентрации, он нашел на соответствующих кривььх ряд переломов, к-рые, по его мнению, указывали на существование определенных химических соединений серной кислоты с водой: H.SO.H.O; H2SO4.2H2O; H2SO4.4H2O: H2S04.6H,0; H2SO4.25H2O; H2SO4:i00H2O. Для хлористого кальция были получены указания на существование соединений CaClg с 2,4 и 6 молекулами воды. Позднейшие исследования Пикериига и Длонса показали, что число действите.тьно существующих в водном растворе Г. значительно меньше указанного Менделеевым. Джонс пололшл основание новой гидратной теории, согласно которой в водных растворах существуют (в противоположность взгляду Менделеева) непрерывные ряды Г. переменного состава, непрочных, легко распадающихся и переходящих друг в друга. Повышение температуры и концентрадии растворенного вещества способствует распадению гидратов. Гидратации могут подвергаться как молекулы, так и отдельные ионы растворенного вещества. Главным доказательством правильности взглядов Джонса является наличие аномально большого нонижения /° замерзания концентрированных растворов, к-рое Джонс объяснил пе увеличением числа частиц растворенного те.та, что для больших концентраций невероятно, а уменьшением чиста частиц свободного растворителя, после того как часть его связалась с ионами растворенного вещества, превратив их в гидрат. Аналогичные аномалии бьуш замечены и для повышения 1°гмп. концентрированных растворов. Другая группа доказательств основана на изучении спектров поглощения рас- творов окрашенных солей. При разбавлении полосы абсорбции суживаются, так как гидратация ионов увеличивается, инерция их растет, и световая энергия с большим трудом может привести их в колебания, обус-ловливаюшие ноглощение света. Различие t°-Hbix коэфф-тов электропроводности при разных концентрациях и для различных солей такне является, по Джонсу, доказательством сушествования Г. С ростом t° электропроводность растворов растет вследствие уменьшения вязкости среды, мешающей передвижению ионов. Если ионы гидратиро-ваны, к этому прибавляется еще и влияние происходящей при повышении t° дегидратации ионов, уменьшающей их диаметр и уве-шчивающей их подвижность. Действительно, Г-ный коэфф. электропроводности больше в слабых растворах (где гидратация больше) и особенно для тех солей, для к-рых и другие методы дают указания о более высокой гидратации (SrCla, AICI3). Степень гидратации канедого иона в отдельности, т. е. количество соединенных с ним молекул воды, определяется двумя методами. Первый из них основывается на том, что при передвижении ионов от одного электрода к другому с шши должна переноситься гидратная вода*, что влечет за собой изменение концентрации какого-либо нейтрального вещества, находящегося в растворе у одного из электродов. Этот метод, впервые указанный Перистом, не привел, однако, к количественным результатам, т.к. оказалось весьма трудным найти действительно нейтральное вещество, которое при передвижении ионов оставалось бы у одного из электродов и не увлекалось бы ими, как и гидратная вода. Другой метод для определения гидратации ионов основан на вычислении размера диаметра и объема гидратированного иона из его подвижности. Вычитая из объема гидратированного иона собственный объем Число молекул воды, соединенных сионом.
нона, пытались определить толщину гидрат-ной оболочки и отсюда, зная размеры молекулы П2О,-число этих молекул, соединенных с ионом. Однако, этот расчет возможен лишь после введения гипотетич. допущений, лишающих полученные числа абсолютного значения. Это видно из сравнения чисел, полученных Ризенфельдом и Рейнгольдом, а также Реми (см. табл.). В обоих случаях степень гидратации П-ио-на условно принималась равной нулю. Абсолютное число молекул воды, соединенных с каждым Н-ионом, неизвестно, но обыкновенно считалось, что Н-ион гидратирован меньше всех других ионов, так как он обладает наибольшей подвижностью. Однако, Бьер-рум, исходя из увеличения активности ионов при высоких концентрациях, вычислил для степени гидратации Н-ионов значение 8, т. е. т. Э. т. V. большее, чем для других ионов (С1-2, К-0). К. Фаянс подошел к вопросу о гидратации энергетически, т. е. попытался найти количество энергии, выделяющееся при гидратации ионов, вычитая из теплоты растворения так называемую энергию решетки (необходимую для преодоления электростатических сил, связывающих ионы соли в кристалл). Он нашел, что энергия гидратации возрастает в общем по мере роста степени гидратации ионов, о которой моншо получить некоторое представление по данным Реми и других: С1-88 Cal, F-129, Cs-72, К-82, Na-98 и т. д. Только для Н-иона получилось неожиданно высокое значение: 260 Cal. Фаянс связал это с исключительно мальш объемом Н-иона (протона) и, следовательно, малым расстоянием, на котором действует притяжение менеду ионом и молекулой воды. Исходя из этих представлений, он считает, что каждый Н-ион соединен с одной молекулой воды; формула гидратированного Н-иона: Н3О. Т.о., степень (или число) гидратации Н-иона очень мала, а энергия гидратации очень велика. В последние годы возник вопрос, можно ли вообще трактовать ионные Г. как химич. соединения определенного состава. Как показал Борн, электрич. силовое поле ионов должно ориентировать молекулы воды, являющиеся диполями (см.), так, что они обращаются своими положительными концами (Н) к отрицательным ионам, и наоборот. Поэтому между ионами и диполями воды должно существовать электростатич. притяжение, к-рое создает вокруг ионов атмосферу из молекул воды, увлекаемых ионом при его движении в электрическ. поле. Т.о., нельзя говорить о связи определенного числа молекул воды с ионом..Он оказывает притягивающее действие на все молекулы HgO в данном растворе, которое, правда, быстро ослабевает по мере удаления от данного иона. Гидратация в водном растворе является частным случаем более общего явления-сольватации растворенного вещества в любом растворителе. Криогидраты нельзя считать гидратами в точном смысле этого слова, так как они представляют собою пе соединение, а смесь льда с определенным гидратом, выпадающую при определенной температуре из раствора, который насыщен данным гидратом. Лит.: М е н д е л е е в Д. П., Основы химии, т. 1, стр. 36-44, М.-Л., 1927; Д ж о н с Г., Основы физич. химии, пер. с англ., 4 изд., СПБ, 1911; И з г а]) ы ш е в П. А., Современная теория растворов. М., 1924; В а л ь д е н П., Ж , часть химическая, 1909, т. 41, стр. 58; W а 1 d е п Р., Das Leitvermogen d. Lo-sungen, Handbuch d. allgem. Chemie unter Mitwirkung vieler Fachleute, hrsg. v. Ostwald W. und Drucker C, B. 4, p. 185, 193, 301, 308, Lpz., 1924; N e г n s t W., Theoret. Chemie vom Standpunkte d. Avogadroschen Regel und d. Thermodynamik, 11-15 Aufl., p. 447, 708, Stg., 1926; Rooseboom В., Ztschr. f.physik. Chemie , Lpz., 1892, B. 101, p, 477; Bjerrum N., Ztschr. f. anorg. u. allgem. Ch. , Lpz., 1920, B. 109, p. 275; Rem у H., Die elektrolytische Wasseruber-fuhrung und ihre Bedeutung f. d. Theorie wasseriger LOsungen, Forsehritte d. Chemie, Physik und physik. Chemie , В., 1927; Fajans K., Verhandlungen der deutschen physikalischen Gesellschaft*, Braunschweig, 1919, Jg. 21, p. 539. A. Рабинович.
|